2022-04-07 14:18 | 來源:證券時報 | 作者:俠名 | [科創(chuàng)板] 字號變大| 字號變小
由公司披露的續(xù)標情況、中標價格以及標期可以初步判斷,集采到期后,短期培美曲塞二鈉產(chǎn)品的營收不會出現(xiàn)大幅度下降。...

4月6日,在第一批集采中爆火的抗腫瘤藥企匯宇制藥(688553)披露了上市以來首份年報。年報顯示,2021年,公司實現(xiàn)營業(yè)收入182,373.31萬元,同比上漲33.69%。歸屬上市公司股東凈利潤44,585.86萬元,同比增長29.87%。歸屬于上市公司股東的扣除非經(jīng)常性損益的凈利潤40,993.71萬元,同比增長26.22%。
主力產(chǎn)品集中度穩(wěn)步下降新品類走出第二增長曲線
據(jù)2021年報,期內(nèi)培美曲塞二鈉已在廣東聯(lián)盟(河南、貴州、廣西、海南、湖南、山西、甘肅、青海、新疆、廣東)繼續(xù)中標,中標價格 599元/支(100mg),標期2年;在江蘇繼續(xù)中標,中標價格525元/支,標期2年,視情況可延長一年;其余地區(qū)新招標方案出臺落實之前,均按原中選企業(yè)延續(xù)執(zhí)行。
由公司披露的續(xù)標情況、中標價格以及標期可以初步判斷,集采到期后,短期培美曲塞二鈉產(chǎn)品的營收不會出現(xiàn)大幅度下降。此外,公開數(shù)據(jù)顯示,近三年培美曲塞二鈉占公司主營業(yè)務(wù)收入的比重分別為92.77%、91.02%、79.49%,昔日拳頭產(chǎn)品已逐漸摘掉匯宇制藥“仿制藥唯一大單品”標簽,公司早已默默啟動了多條仿制藥“第二增長曲線”。
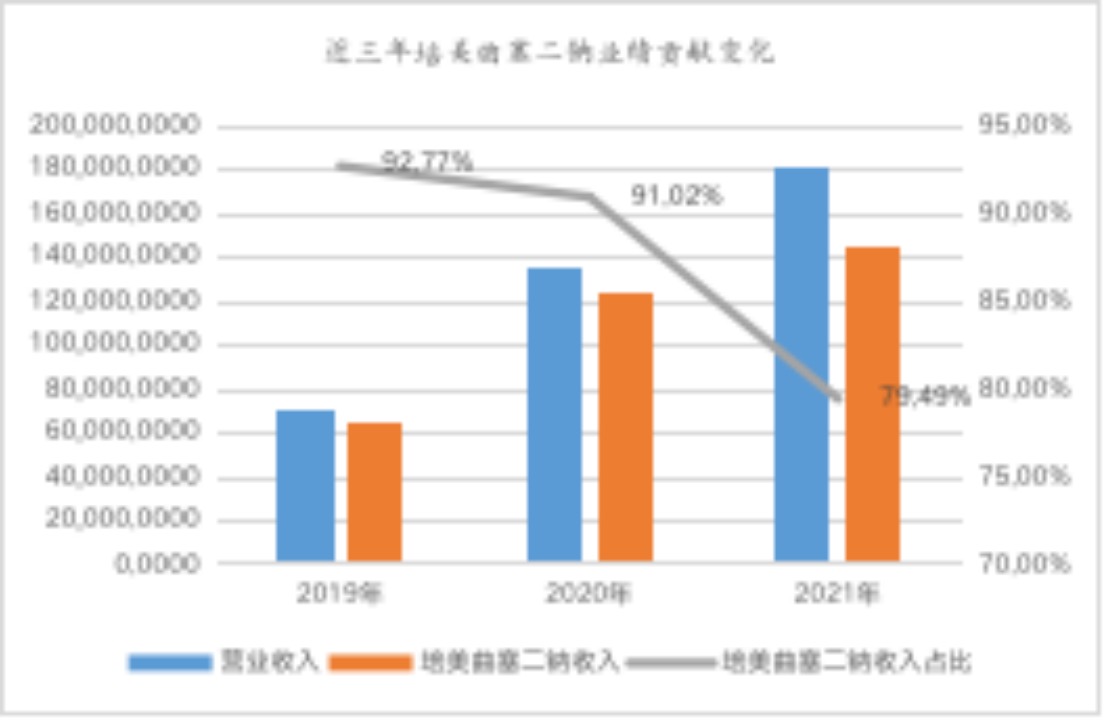
數(shù)據(jù)來源:wind
截至年報披露日,公司有注射用培美曲塞二鈉、多西他賽注射液、注射用阿扎胞苷、紫杉醇注射液、奧沙利鉑注射液、注射用鹽酸苯達莫司汀、伊立替康注射液、鹽酸帕洛諾司瓊注射液、注射用硼替佐米、左乙拉西坦注射用濃溶液等10個藥品獲批上市,多個品種為首家或前三家視同通過注射劑一致性評價。其中注射用培美曲塞二鈉、多西他賽注射液、注射用阿扎胞苷、紫杉醇注射液、奧沙利鉑注射液、注射用鹽酸苯達莫司汀、伊立替康注射液分別進入國家集采。報告期內(nèi),公司產(chǎn)品注射用阿扎胞苷銷售大幅增長,第五批集采產(chǎn)品中選銷售增長迅速;報告期培美曲塞二鈉實現(xiàn)銷售收入144,690.54萬元,較上年同期增長17.09%;多西他賽注射液銷售收入15,063.78萬元,較上年同期增長64.68%;注射用阿扎胞苷實現(xiàn)銷售收入10,540.31萬元,較上年同期增長487.69%。
匯宇制藥在此前披露的機構(gòu)調(diào)研記錄中表示,雖然培美曲塞在已續(xù)接標地區(qū)價格有所下降,但第三批國家集采中選藥品阿扎胞苷會持續(xù)增長,第五批集采中標的4個品種已開始供貨,2022年將開始放量貢獻收入,第七批集采公司伊立替康已被納入集采品種,第八批集采預(yù)計也會有產(chǎn)品納入。同時目前公司注冊待批準的有12個品種,其中普樂沙福單價非常高,丙戊酸鈉、氟維司群等市場容量很大。另外,預(yù)計公司2022將遞交注冊約20個品種,不同階段的仿制藥、復(fù)雜注射劑陸續(xù)都會遞交注冊并獲批,將會有持續(xù)不斷的品種獲批上市,為公司貢獻收入。
由此來看,類似匯宇制藥這樣在集采政策下能夠持續(xù)長期收益的仿制藥企業(yè),離不開其較強科研能力,以及豐富的產(chǎn)品線等核心競爭力因素,以此為基礎(chǔ),匯宇制藥的大多數(shù)產(chǎn)品才能率先通過一致性評價,并持續(xù)在帶量采購模式下?lián)屨际袌觥?/p>
仿制藥持續(xù)快速發(fā)展推動“以仿養(yǎng)創(chuàng)”模式愈發(fā)穩(wěn)健
匯宇制藥的戰(zhàn)略發(fā)展路徑是“以仿養(yǎng)創(chuàng)—仿創(chuàng)結(jié)合—以創(chuàng)為主”的三步走規(guī)劃,故免不了面臨所有走“以仿養(yǎng)創(chuàng)”模式的藥企,共同要面對的質(zhì)疑點:用仿制藥能否支撐創(chuàng)新藥研發(fā)的巨大投入?以仿養(yǎng)創(chuàng)模式的“續(xù)航”能力究竟如何?
首先,從在售產(chǎn)品來看,截至報告披露日,在國內(nèi),公司有注射用培美曲塞二鈉、多西他賽注射液、注射用阿扎胞苷、紫杉醇注射液、奧沙利鉑注射液、注射用鹽酸苯達莫司汀、伊立替康注射液、鹽酸帕洛諾司瓊注射液、硼替佐米、左乙拉西坦注射用濃溶液等10個藥品獲批上市,多個品種為首家或前三家視同通過注射劑一致性評價,營銷網(wǎng)絡(luò)覆蓋全國各省、市、自治區(qū)超過2000家等級醫(yī)院;在海外,公司已有12個品種獲批上市,超過200個批件(含自主持有及授權(quán)合作方持有),覆蓋51個國家和地區(qū),同時已在約100個國家建立了銷售渠道,累計在境外超過40個國家、超過1000家醫(yī)療機構(gòu)上市銷售。從近三年穩(wěn)定增長的營業(yè)收入及凈利潤情況看,現(xiàn)有仿制藥產(chǎn)品市場空間及回報均相對穩(wěn)定。
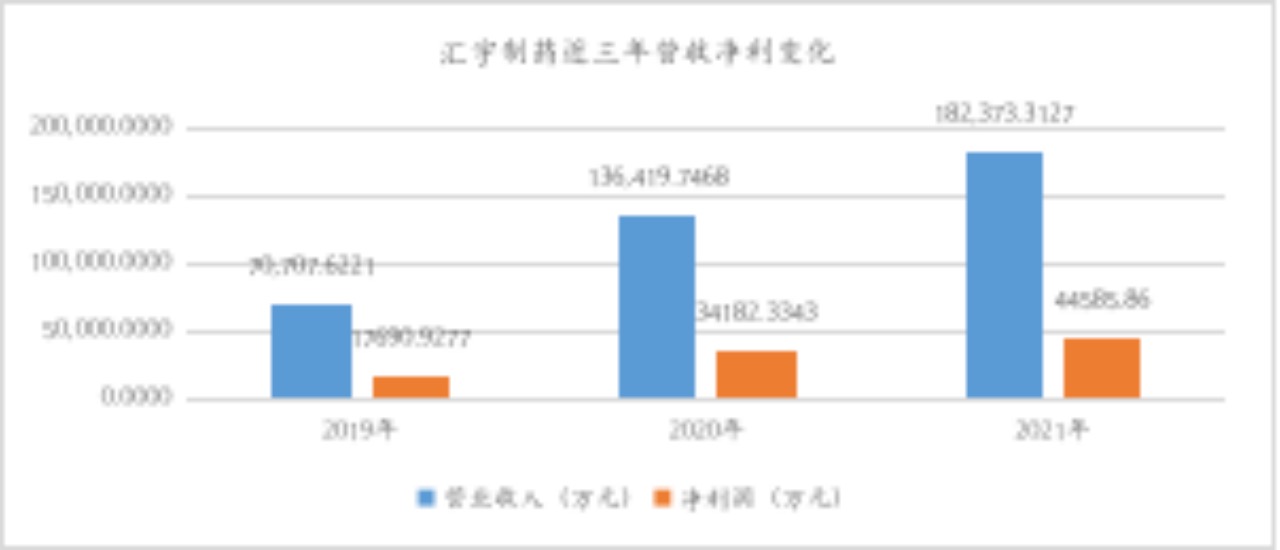
數(shù)據(jù)來源:wind
其次,從新產(chǎn)品及研發(fā)管線情況看,報告期內(nèi),匯宇制藥中標第五批全國藥品集中采購,中標品種包括奧沙利鉑注射液、多西他賽注射液、紫杉醇注射液以及注射用苯達莫司汀,并于2021年9月開始陸續(xù)執(zhí)標,其中奧沙利鉑注射液、紫杉醇注射液以及注射用苯達莫司汀均為公司新增國內(nèi)上市品種,將為公司貢獻新的業(yè)績增長點。
另外,匯宇制藥在年報中還披露了國際市場前景極大的復(fù)雜注射劑相關(guān)產(chǎn)品進展。年報顯示,公司的復(fù)雜注射劑等重磅品種將會從今年開始陸續(xù)申報國內(nèi)外注冊,包括戈舍瑞林、蘭瑞肽、環(huán)磷酰胺、紫杉醇白蛋白、多柔比星脂質(zhì)體、鐵劑等。這些復(fù)雜注射劑均具有市場規(guī)模大、技術(shù)壁壘高、有實力的競爭者少等特點。舉個例子,公開數(shù)據(jù)顯示,2020年國內(nèi)多柔比星脂質(zhì)體銷售額已超過41億,戈舍瑞林植入體在中國院內(nèi)市場規(guī)模為30.50億元,前景不可限量。
匯宇制藥在年報中也表示,在中短期公司仍著力仿制藥研發(fā),一方面品種數(shù)量多、管線豐富,另一方面復(fù)雜注射劑等重磅品種將會從今年開始陸續(xù)申報國內(nèi)外注冊。綜合在售產(chǎn)品,待售新產(chǎn)品,以及儲備在研項目的情況,匯宇制藥在仿制藥領(lǐng)域持續(xù)收益、為創(chuàng)新藥研發(fā)不斷造血的能力還是有明確數(shù)據(jù)支撐的。
創(chuàng)新藥重磅產(chǎn)品將報臨床研發(fā)管線兌現(xiàn)確定性強
隨著創(chuàng)新藥概念板塊的理性回調(diào),以及國家政策引導(dǎo)下對創(chuàng)新藥的真創(chuàng)新能力、國際競爭力的要求,資本市場對于“以仿養(yǎng)創(chuàng)”階段的企業(yè)何時能夠踏上創(chuàng)新藥軌道的關(guān)注,就變得更加明確且急迫。
匯宇制藥稱,在創(chuàng)新藥領(lǐng)域重點布局的是全球范圍內(nèi)同類產(chǎn)品尚未進入臨床研究階段的first-in-class和me-better品種,從靶點方向上看符合可持續(xù)發(fā)展的創(chuàng)新藥企基礎(chǔ)條件。年報數(shù)據(jù)顯示,2021年公司研發(fā)費用24,821.22萬元,同比增長179.60%,其中創(chuàng)新藥研發(fā)投入7,558.22萬元,同比增長720.51%。
在研發(fā)團隊上,匯宇制藥共有研發(fā)人員642名,同比增長超過50%,其中創(chuàng)新藥團隊139名,包括碩士和博士89名,且牽頭人畢業(yè)于劍橋、哈佛、北京大學(xué)等全球知名院校,此外,匯宇制藥還從海外產(chǎn)業(yè)界挖了不少大牛,比如在美國SNTA負責(zé)一類FIC創(chuàng)新藥團隊管理和藥物研發(fā)的高級總監(jiān)陳壽軍,以及禮來的首席科學(xué)家和資深研究顧問韋濤。
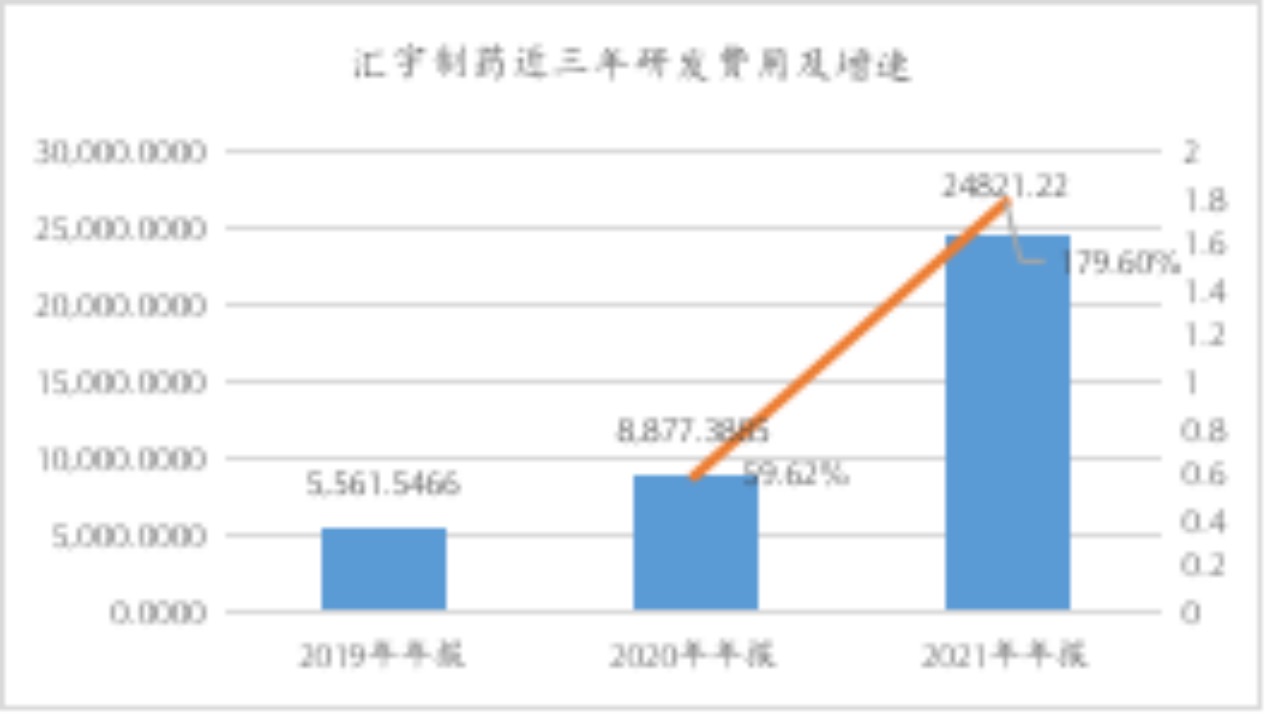
數(shù)據(jù)來源:wind
對于創(chuàng)新藥的最新研發(fā)進展,匯宇制藥在年報中披露,2021年,公司全面加速生物和化學(xué)創(chuàng)新藥研發(fā),持續(xù)完善團隊建設(shè)和技術(shù)平臺建設(shè),搭建并完善了創(chuàng)新藥研發(fā)的各個平臺,各項體系和管理日趨成熟,為創(chuàng)新藥全力沖刺夯實了基礎(chǔ)。同時10個一類創(chuàng)新藥項目都取得了良好進展,基本都找到了較好的潛在候選藥物。2022年,公司預(yù)計將有約5個一類創(chuàng)新藥推進至PCC階段,力爭1-2個產(chǎn)品申報臨床公司。同時,創(chuàng)新藥海外市場的準備工作已經(jīng)同步開展。目前,公司已在美國成立子公司,并設(shè)立了“美國和創(chuàng)新藥事業(yè)部”,后續(xù)公司將大力推進創(chuàng)新藥海外授權(quán)相關(guān)工作。這無疑是匯宇制藥邁向“仿創(chuàng)結(jié)合”模式的一個重大突破。
已啟動美國FDA認證工作國際市場布局全球開花
在國際市場基礎(chǔ)布局方面,期內(nèi)公司在英國已經(jīng)獲得11個藥品的上市許可,海外自主和授權(quán)合作方持有批件總數(shù)超過200個,覆蓋51個國家;在質(zhì)量體系標準方面,公司多次通過了中國、英國的GMP 認證,并通過芬蘭GMP認證,目前已啟動美國FDA認證相關(guān)工作;在國際注冊法規(guī)把控方面,公司建設(shè)和培養(yǎng)了一支理論和實操經(jīng)驗豐富的優(yōu)秀國際注冊團隊。
該團隊通過全面掌握藥事法規(guī),協(xié)助研發(fā)部門快速研發(fā)出符合國際注冊法規(guī)的藥品,實現(xiàn)了生產(chǎn)、技術(shù)、質(zhì)量和銷售部門合規(guī)運行,結(jié)合公司強大的研發(fā)能力、符合歐美GMP標準的生產(chǎn)和質(zhì)量體系,各自的優(yōu)勢互相配合形成了相互促進的協(xié)同效應(yīng)。以上逐步積累起來的國際化優(yōu)勢,無疑將成為匯宇制藥未來邁向全球的有力武器。
《電鰻快報》
熱門






4
5
6
7
8
9
10

信息產(chǎn)業(yè)部備案/許可證編號: 京ICP備17002173號-2 電鰻快報2013-2022 www.www.cqjiade.com
相關(guān)新聞